三大標準療法に行き詰まった患者の今
『新たな保険外併用の仕組みの創設』
内閣府現制改革推進室
参事官 大熊 裕二
参事官 大熊 裕二
「生きたい」、「助けてあげたい」と願い新薬や新しい治療機器の使用を渇望する患者や家族の願いの前に立ちはだかる、「未承認薬」、「未承認機器」という大きな壁。
この壁に微かな隙間をこじ開けようとしているのが「患者申出療養(仮称)」制度だ。
今国会で成立の見込みと言われているが、昨年6月4日「未承認の医薬品等の迅速な使用を求めて
『保険外併用療養費制度における新たな仕組みに関する意見』」
http://www.com-info.org/medical.php?ima_20140604
に引き続き、現状について内閣府現制改革推進室の大熊 裕二参事官にうかがった。 以下は規制改革担当大臣と厚生労働大臣の合意文書である。
http://www.com-info.org/medical.php?ima_20140604
に引き続き、現状について内閣府現制改革推進室の大熊 裕二参事官にうかがった。 以下は規制改革担当大臣と厚生労働大臣の合意文書である。
(會田 昭一郎)
患者申出療養制度の創設にあたり、規制改革担当大臣と厚生労働大臣の間で下記の合意がなされ、現在それに沿って法案等が準備されています。施行は平成28年4月の予定になります。
1.趣旨
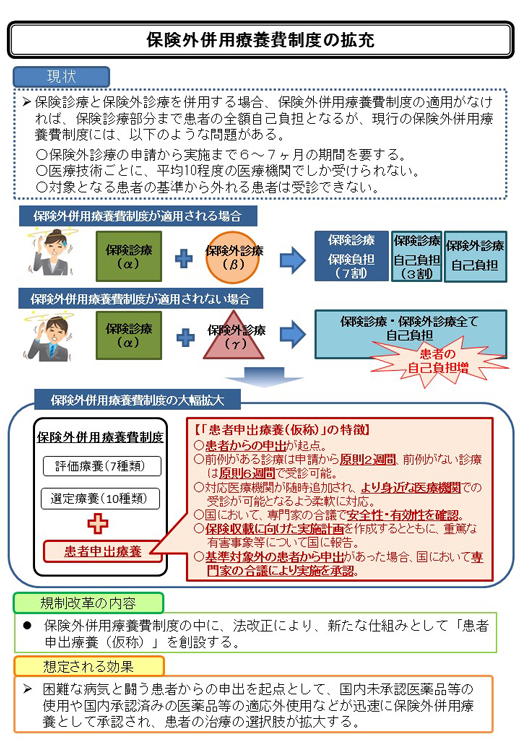
困難な病気と闘う患者からの申出を起点として、国内未承認医薬品等の使用や国内承認済みの医薬品等の適応外使用などを 迅速に保険外併用療養として使用できるよう、保険外併用療養費制度の中に、法改正により、 新たな仕組みとして「患者申出療養(仮称)」を創設し、患者の治療の選択肢を拡大する。
2.対応方針
「患者申出療養(仮称)」は、医師が治療の内容や安全性・有効性などを患者に対して十分説明し、 患者が理解、納得したうえで申出することを前提とする。 対応医療機関の安全・適切な診療体制が整っていることを確認し、診療内容に応じて、 できるだけ患者に身近な医療機関で、迅速に受診できるようにする。
(1)対応医療機関
未承認の診療に関する豊富な知見を有する臨床研究中核病院と患者に身近な地域の医療機関が、 診療内容に応じて連携協力を図りながら、患者からの申出に係る診療をできる体制を構築する。
※例えば、リスクの高いものは大学病院や地域の基幹病院、 リスクの低いものは対応可能な地域の病院で受けられるようにする。
※患者からの申出に対応できない場合は、実施可能な医療機関に紹介する。
(2)承認までの期間
①「患者申出療養(仮称)」としての前例がある診療
臨床研究中核病院の他、患者に身近な医療機関(予定協力医療機関等)が、患者から申出を受け、 前例を取り扱った臨床研究中核病院に対して申請(共同研究の申請)する。 (従来は臨床研究中核病院が国へ共同研究の申請)
申請から原則2週間で臨床研究中核病院が判断し、受診できるようにする。
②「患者申出療養(仮称)」としての前例がない診療臨床研究中核病院が、患者から申出を受け、国に対して申請する。
申請から原則6週間で国が判断し、受診できるようにする。
患者に身近な医療機関を最初から対応医療機関(協力医療機関)として申請(共同研究の申請)する場合は、 その医療機関で受診できるようにする。
※事前相談等も活用する。
※この期間を超えて審査に時間を要する場合(論文の分量が多い、医学的判断が分かれる等)、 国は理由を付して臨床研究中核病院に通知する。
(3)対応医療機関の充実
① 臨床研究中核病院は、15ヵ所に限定することなく、要件を満たせば追加していく。
※現在、一定の要件を満たした病院を臨床研究中核病院として承認する法制度を盛り込んだ医療法改正案を提出中。
② 臨床研究中核病院が申請時に対応医療機関(共同研究の予定協力医療機関)のリストを添付し、 患者が身近に受診できる医療機関を周知する。
③ 臨床研究中核病院の承認により、対応医療機関(協力医療機関)を随時追加する。この旨、厚労省からも要請する。
3.安全性・有効性等の確認
(1)国において、専門家の合議で安全性・有効性を確認する。
エビデンスのある診療はできるだけ対象とする方針で運用する。
そこでの議論や手続きを迅速かつ効率的に進めるため、運営のあり方について、新しい仕組みの施行までに検討する。
(2)保険収載に向け、治験等に進むための判断ができるよう、実施計画を作成し、国において確認するとともに、実施に伴う重篤な有害事象や実施状況、結果等について報告を求める。
保険収載のための長期的な評価が必要なものも対象とする。
(3)実施計画の対象外の患者から申出があった場合は、臨床研究
中核病院において安全性、倫理性等について検討を行った上で、国において専門家の合議により実施を承認する。