『乳がんの術後放射線治療で最先端の技術を推奨する理由(1)』
札幌高機能放射線治療センター センター長
岸 和史
今回は乳がん、特に左乳房のがんの場合の放射線照射と心臓との関係などを事例に、北海道大野記念病院 副院長で札幌高機能放射線治療センター センター長の岸 和史先生に解説していただいた。長文であるので2週にわたり連載させていただきます。
はじめに
私たちはがんの病巣を破壊したり、がんでなくとも異常な活動を抑制したりするために強い放射線を照射します。放射線治療にも沢山の最先端の技術が入ってきました。現在の最先端の技術の真価は、かけがえのない正常組織を、破壊せず、温存しながら病変を制御することです。
2016年のいま、それらの最先端の技術が従来技術と比べて、具体的にどういう利点が期待できるのか、述べさせていただきたいと思います。
データで30年後まで予測できる
まず米国で膨大な長期間の追跡医療データが集積され、それがオープンソースとなって世界中の科学者が自由に分析できるようになりました。その蓄積によって、ここ最近では、治療して30年の後の影響まで予測できるようになりました。
従来技術について
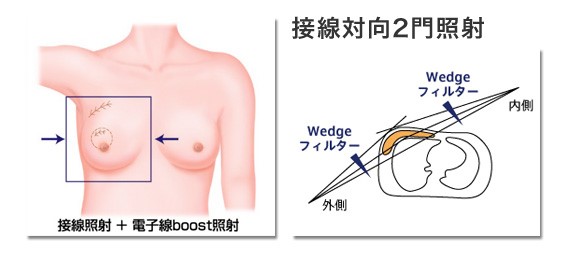
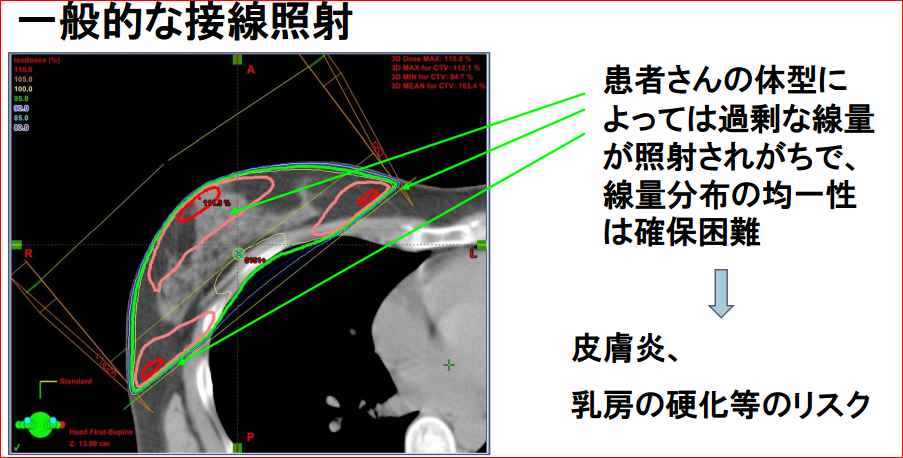
従来技術では斜め2方向から乳房を斫(はつ)るように、下図1のように放射線を照射し、肺への照射線量の低減をはかります。この従来技術は今でもまだゴールデンスタンダードです。放射線治療計画ガイドライン2012では“全乳房照射は両側あるいは患側上肢を挙上して接線対向 2 門照射(接線照射といいます)で行うのが一般的である。”と書いています。従来技術は2次元あるいは3次元の照射方法とよばれたりもしています。正常組織を守るのにこの従来技術で本当に充分なのでしょうか? 乳癌に対する放射線治療後の心臓への影響を調べた研究成果が、世界中から報告されました(1-3)。
http://www.kms.ac.jp/~secsurg/endoc/guid/
https://www.city-hosp.naka.hiroshima.jp/dl/k_net/cancer_workshop_20140515_5.pdf ネットで公開されています。
従来技術での標的への均一な照射
ま四角でない乳房に従来技術できちんと均一に照射する、標的への線量のムラをなくすること自体が大きな課題でした。この克服のために現場ではいろいろな工夫を駆使します(図1B)。それぞれの施設で行われている表(おもて)に出ないこのような誠実な工夫はとても大切なことなのです。従来技術でも乳房にほぼ均一に照射できますから。
高精度の外部放射線治療は登場しましたが…
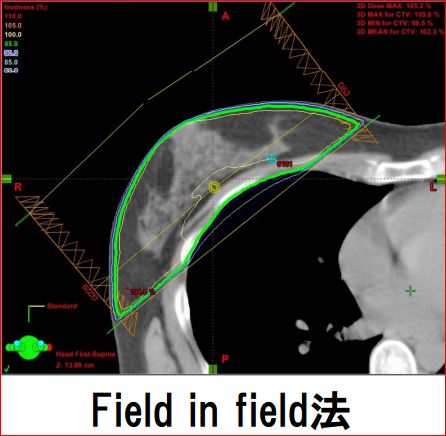
それらの工夫が精緻で自動的なシステムとして発達したのがIMRT技術等を核とした“高精度外部放射線治療”の機械です。ところが乳がんの術後放射線治療に国内ではまだIMRT以上の技術を使っているところは少なく、ほとんどが、対向2門のような2次元、あるいは3次元照射の、先ほど従来技術で行われているようです。“ほぼできる”ことが、少しぐらい完全にできても、メリットは大きく増えないという考え方です。従来技術であっても高精度技術であっても術後照射をした時の再発抑止力自体には差がありません。でも、それは何か大切なことを忘れていませんか? それは正常組織を守る技術への評価です。
放射線の晩発性障害は何年も後に発生します。短期的な効果しか見ないような考え方ではその大切さがわかりません。あなたならどうしますか?
従来技術で照射した場合の問題点の報告
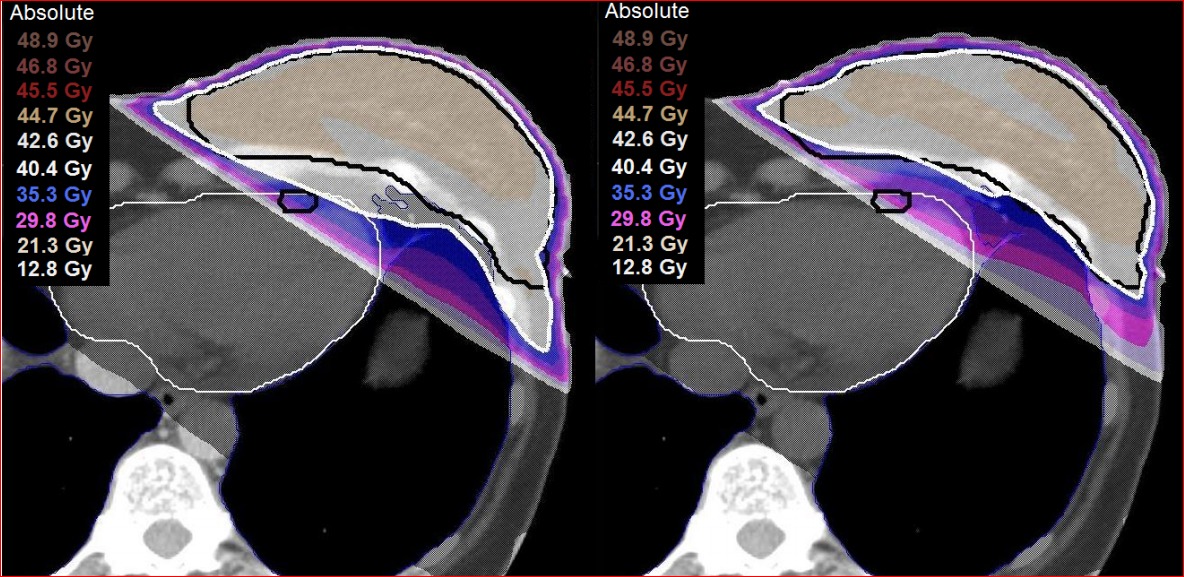
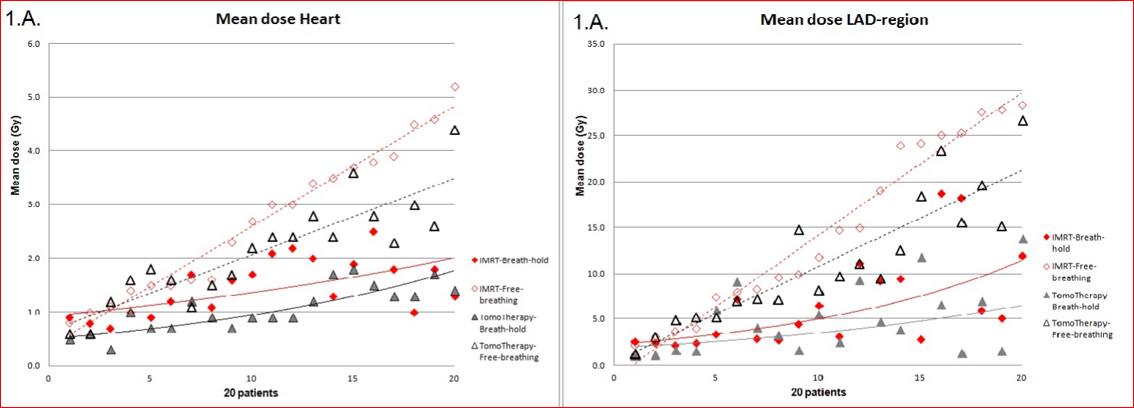
従来技術で左乳房を照射すれば心臓の一部が強く照射されてしまいます。放射線の心臓に対する毒性はかねてから問題にされていました(4)。科学的な解析手法が進化した最近になって、心臓での晩発性の放射線障害の頻度やリスクが、冠状動脈障害による心筋虚血の重要性が判明し、心臓の平均線量と、心臓を栄養する最も大切な動脈である冠動脈左回旋枝(left anterior descending branch of the coronary artery, LAD)の平均線量で評価されるようになりました。オランダのEsther・Mast先生達は、通常の対向2門照射とIMRTを比較しIMRTのほうがよりLADを温存できることを報告しました(図1C)(5)。
http://hdl.handle.net/1887/32932
http://hdl.handle.net/1887/32932
比較論文
トップランクの高精度放射線治療機のどれが、どれだけうまく心臓(冠動脈)を回避できているか、肺への不要な照射も回避できるか、いったいどちらの照射装置が優れているかを白日の下に比較してみようという試みは世界中の関心を集めています。
世界にはいくつかトップランク機械を取り揃えた贅沢な施設があります。日本ではベンダーに遠慮してなのか、そのような報告をみませんが、そういう施設の先生は報告する義務があると私は思います。
乳房の術後照射の比較論文を紹介します。台湾の極東記念病院のAn-Cheng Shiau先生達は左乳房への術後照射の同一症例でIMRTの線量分布とTomotherapyの線量分布を比較し、いずれもTomotherapyのほうが秀でていたと報告しています(6)。図2Aで肺と心臓の両方において、どちらのほうがたくさんの正常組織への照射をしているか、よく見ればそれほど分かり難くは無いでしょう。
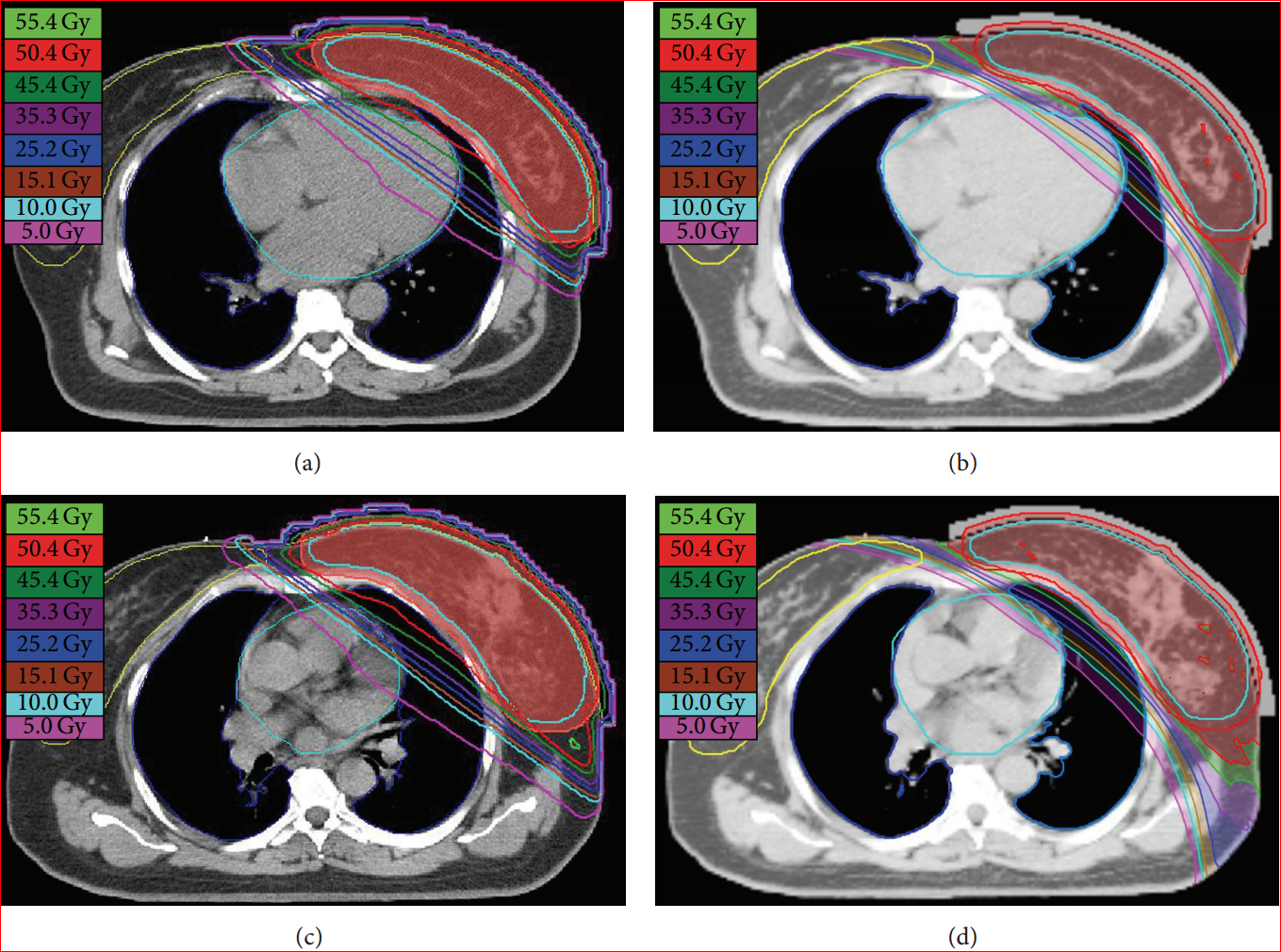
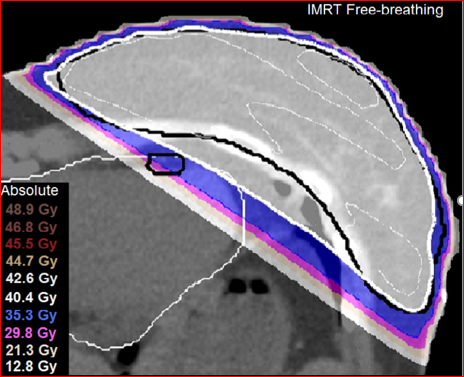
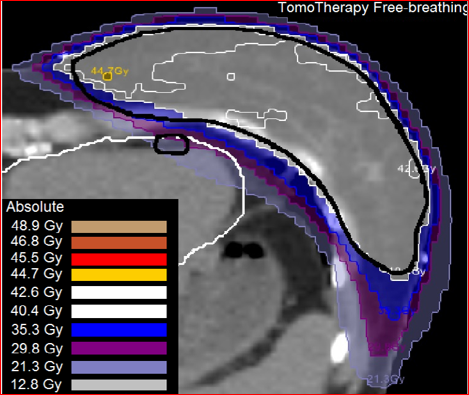
オランダのライデン大学(Universiteit Leiden)のMirjam Esther・Mast先生達は、冠動脈左回旋枝の温存能を比較し、やはりIMRTよりもTomotherapyのほうが優れていたとのべています(図2B)(5)。さらに彼は、心臓の平均線量と左回旋枝の平均線量を比較し、いずれもTomotherapyのほうが低く良好結果であったと報告しました(図2C)。
http://hdl.handle.net/1887/32932
References
- 1. Darby SC, Ewertz M, McGale P, Bennet AM, Blom-Goldman U, Bronnum D, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med. 2013;368(11):987-98.
- 3. Giordano SH, Kuo YF, Freeman JL, Buchholz TA, Hortobagyi GN, Goodwin JS. Risk of cardiac death after adjuvant radiotherapy for breast cancer. J Natl Cancer Inst. 2005;97(6):419-24.
- 4. Doyle JJ, Neugut AI, Jacobson JS, Wang J, McBride R, Grann A, et al. Radiation therapy, cardiac risk factors, and cardiac toxicity in early-stage breast cancer patients. Int J Radiat Oncol Biol Phys. 2007;68(1):82-93.
- 5. Shiau AC, Hsieh CH, Tien HJ, Yeh HP, Lin CT, Shueng PW, et al. Left-sided whole breast irradiation with hybrid-IMRT and helical tomotherapy dosimetric comparison. Biomed Res Int. 2014;2014:741326.
- 6. Liu Y, Shiau C, Lee M, Huang P, Hsieh C, Chen P, et al. The role and strategy of IMRT in radiotherapy of pelvic tumors: Dose escalation and critical organ sparing in prostate cancer. Int J Radiat Oncol Biol Phys. 2007;67(4):1113-23.
1983年和歌山県立医科大学医学部医学科卒業後、同大学助手(放射線医学講座)、講師、助教授、准教授を経て2013年医療法人北斗 北斗病院放射線治療科部長、2014年より副院長。2016年10月15日の開院日をもって現職。
この間1997年米国テキサス州立大学MDアンダーソン癌センター実験放射線腫瘍学教室にPostdoctoral Fellowとして留学
日本放射線腫瘍学会認定医、放射線治療専門医、医学博士

