『AACR2019に参加して』
昭和大学病院腫瘍センター長
角田 卓也
1.より臨床的に、より患者さんに近く
今年、米国アトランタで開催されましたAmerican Association of Cancer Research(AACR、米国がん学会)2019の報告をさせていただきます。 私の教室からポスタープレゼンテーションもあり参加して参りました。 まず最初に、最近のAACRは従来の基礎研究中心というより、以前より臨床に近い研究発表が多いとの感想は我々の仲間で共有しております。 臨床が中心のAmerican Association Clinical Oncology (ASCO、米国臨床腫瘍学会)と比べて基礎的な部分に重みはおいておりますが、 ここ最近特に臨床寄りになってきているという印象を持っているのは私だけではないと思います。 私が最初にAACRに参加した30年ほど前はほとんどがんに関する基礎研究ばっかりでその分野の専門家でないと理解できなく、とても難解であった記憶があります。 基礎的な発見がどのように臨床(患者さん)に繋がっていくのかを強く意識した研究が多いと思います。 このことはいい面も悪い面もあると思いますが、がん患者さんに研究成果を還元するのだという一つの方向性であると考えております。

入口の本年大会のスローガン等
2.AACR2019のテーマ
Integrative Cancer Science・Global Impact・Individual Patients Careですが、日本語に訳しますと(統合したがん科学・地球規模のインパクト・個々の患者のケア)となります。 意味するとことは、新たなゲノム研究や免疫研究など全てを統合し地球規模で患者個々に適したがん治療への模索、でしょうか? また、今までのPrecision Medicineではなく、Precision Oncologyと言うターミノロジーが流行っておりました。 精緻な腫瘍学、精緻ながん治療という意味です。
本学会の会長(President)はElizabeth M. JaffeeはJohns Hopkins大学の高名な免疫学者です。 その影響もあるのか内容はひいき目に見ても50%以上はがん免疫療法の話題でした。
昨年のノーベル医学生理学賞の影響もあり、Fellows of the AACR Academy class of 2019には京都大学の本庶佑教授も選出されておりました。

2019年特別研究員のリスト
また、最近のがん免疫療法の爆発的な発展のきっかけとなった抗CTLA-4抗体であるIpilimumabについて、 本庶教授と同時にノーベル賞を受賞されたJames P Allison博士を中心に、その臨床試験責任者、抗体作製者など一堂に会したセッションがありました。 もちろん発見者はリスペクトされるべきですが、それぞれの役割を十分に生かし、がん治療に素晴らしい結果をもたらした成果を上げました。 今後、間違いなくがん薬物療法の中心的役割をはたすがん免疫療法はこうして世に出たのだというドキュメント番組を見ているようでたいへん興味深いものでした。
3.今後のがん免疫療法は?
以前よりご報告しておりますが、がんに対する薬物療法おいて、たとえステージIVの進行がん(がんがもとあった原発部位に留まらず他の臓器に転移した状態)でも、がん免疫療法だけが完治をもたらすことができます。 このがん免疫療法は、本庶教授やAllison博士の発見による免疫チェックポイント阻害剤によるものです。 表に示すように免疫抑制解除療法という分類に入ります。
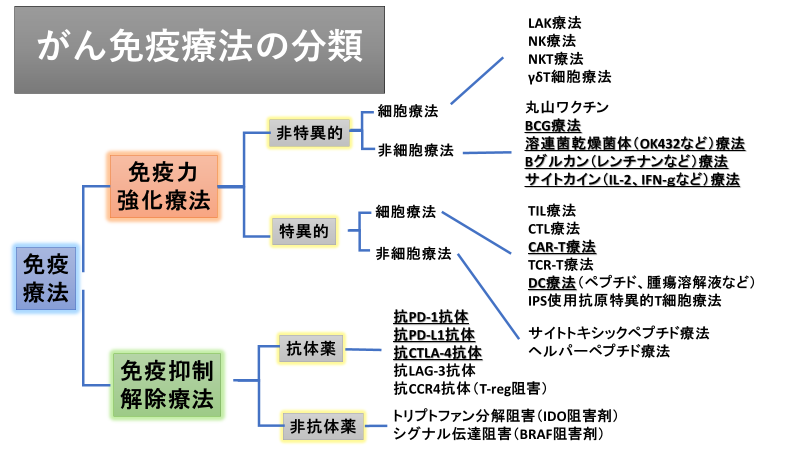
これは、たとえ進行がん患者でも既に自分のがんに対する強い免疫反応が起こっているが、免疫チェックポイントで抑制されている。 免疫チェックポイント阻害剤はそれを外すことで強力な抗腫瘍効果を出すことができたということです。
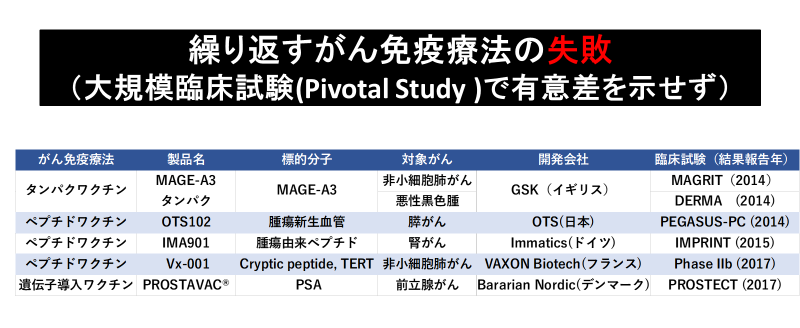
しかし、表に示すように従来がん免疫療法で熱心に取り組まれていた免疫強化療法は大規模臨床試験(Pivotal Study )で有意差を示せず、失敗の繰り返しでした。
4.ネオアンチゲンによる免疫強化療法、最後の砦?
免疫強化療法は本当に役に立たないのでしょうか?最近、ネオアンチゲンを用いたワクチン療法が有効かもしれないと言われています。 ネオアンチゲンの説明をします。 がんは遺伝子異常の集積です。 特にアミノ酸変異を伴う変異はそれを監視している免疫反応であるリンパ球から見ると全く異物ととらえられ、その抗原の対する強い細胞障害性T細胞(CTL)反応をおこします。 この強いCTL反応を惹起する患者自身のがん細胞遺伝子変異由来の抗原をネオアンチゲンといいます。 理論的にたいへん期待できるものであり、Neonなど実際に全世界でバイオベンチャー中心に臨床開発が進んでいます。 しかし、その詳細な解析は全くされていませんでした。
AACR2019でたいへん興味深い発表がありました。 がん免疫療法の権威であり大御所でもある米国National Cancer Institute(NCI)のSteven A. Rosenberg博士のプレナリーセッションでの発表です。 タイトルは、T cell therapy targeting unique cancer mutationsというもので、「ユニークながんの変異を標的としたT細胞療法」です。 すなわち、「ユニークながんの変異」は「ネオアンチゲン」と同じです。

Steven A. Rosenberg博士(NCI)のプレナリーセッションでの発表
博士らのグループは、詳細は省きますが、大変精緻な方法で「ユニークながんの変異」すなわち「ネオアンチゲン」を同定しています。 更に機能的にも変異抗原であることを証明しております。ポイントは、
- 1 悪性黒色腫と一般的な上皮性腫瘍(一般的ながん、胃がんや乳がん、大腸がんなど)ではネオアンチゲンを認識するCTLが違うこと、 すなわち、悪性黒色腫ではネオアンチゲンを認識できるリンパ球は、CD8陽性T細胞(古典的なCTL)がほとんどであり(CD8 vs CD4=94% vs 6%)、 上皮性腫瘍はCD4陽性T細胞とCD8陽性T細胞が同じ程度である(CD8 vs CD4=49% vs 51%)。
- 2 全ての変異を調べ、その変異がネオアンチゲンである事の証明として免疫反応を示すかどうか解析してみると悪性黒色腫では、 3938個の変異のうち免疫反応があったものは54個。 よって、54/3938=1.4%のネオアンチゲン。上皮性腫瘍では、同様に、7498個の変異で120個。 よって、120/7498=1.6%のネオアンチゲンであった。
- 3 上皮性腫瘍で197個のネオアンチゲンを解析したが、全く同じものは2個のみであり、悪性黒色腫では54個ネオアンチゲンを解析したが、全く同じものは一つもなく、 患者によって全くpersonalizeしておりバラバラであった。(Bad Newsと言っていた)
- 4 調べた限りほぼ全ての症例でネオアンチゲンが存在した。(Good Newsと言っていた)
- 5 一般的な予測アルゴリズムでの同定率は著しく低く、ほぼ役に立たない。
以上より、ネオアンチゲンを予測して投与する際は少なくとも70個以上のペプチド抗原を投与しなくては科学的に意味がないことが明白になりました。 また、一般的ながんである上皮性腫瘍では、CD4陽性T細胞が半分を占め、これを活性化できるペプチドが必要です。 このようにまだまだ科学的にも不明な点が多く詳細な解析が待たれます。
個人的には免疫活性化療法のみでは十分な抗腫瘍効果を含め免疫療法の最大の利点である長期生存者が出にくいと考えており、免疫チェックポイント阻害剤との併用が必須ではないかと思います。
次回はASCO2019に参加して世界最先端の情報を皆様に共有させて頂きます。
1987年和歌山県立医科大学卒業後、同大学第二外科助教を経て2000年東京大学医科学研究所付属病院外科講師。 同院准教授を経て2006年ワクチンサイエンス株式会社、代表取締役・社長。 2010年オンコセラピーサイエンス株式会社、代表取締役・社長。 2015年メルクセローノ株式会社、MA Oncology部長を経て2016年昭和大学臨床薬理研究所臨床免疫腫瘍学講座・教授、 2018年昭和大学医学部内科学部門腫瘍内科学部門・主任教授、昭和大学病院腫瘍センター長
1992-1995年City of Hope National Cancer Institute (Los Angeles)留学、同講師就任
医学博士(テーマ:腫瘍浸潤リンパ球の基礎的・臨床的研究)

