『有機フッ素化合物(PFAS)とがんリスク』
原田 浩二
今年に入ってからPFASについての行政の動き、報道が多くなってきた。 昨年に沖縄県の市民により血液中のPFAS濃度調査が行われて、その結果、環境省による日本の他の地域で行われた検査結果より平均濃度で数倍高い結果となったことが報道されたことがきっかけではないか。
PFASとは有機フッ素化合物という、フッ素を含む有機物の一群である。歯磨き粉などに含まれるものは無機フッ素であるので区別する必要がある。 PFASはより正確にはフッ素化アルキル化合物(per- and polyfluoroalkyl substances, PFAS)と呼ばれるものである。 PFASは定義にもよるが経済協力開発機構ではPFASに該当する化学物質が4730種類以上と見積もっている。 PFASは1940年代より商業的に開発されてきたもので、撥水・撥油剤(衣料品の防水加工、食品容器などのコーティング)、 泡消火剤(航空施設、軍事施設、立体駐車場など、燃料火災の消火用)、フッ素樹脂の製造過程での助剤、半導体製造、金属メッキの添加剤などとして利用されてきた。 有機物にフッ素原子が加わるとこれまでにない機能が付加され、化学的にも安定である。 裏返せば、環境中で長く残留する。人工の化学物質であり、環境中で長期に残留することから「永遠に残留する化学物質」、‘Forever Chemicals’とも呼ばれている。
PFAS汚染の公表と国際的な規制
このPFAS問題は主に2000年に知られるようになった。 大手のPFASメーカーであった米国3M社が、2000年5月にPFASのうち、ペルフルオロオクタンスルホン酸(PFOS)とペルフルオロオクタン酸(PFOA)の2物質の製造を自主的に止めることを発表した。 関連製品に年間3億ドルの販売があったが、環境残留性、野生生物やヒトへの蓄積性、高用量ではあるがラットなどの実験動物で発達毒性などが見られることが理由であった。 3M社はその後、各地の工場などの近隣住民からの訴訟を抱え続け、2022年12月に2025年までに全てのPFAS製造から撤退することを明らかにした。 また2023年6月の暫定和解案では100億ドルの支払いに合意した。
3M社だけでなく多くのフッ素化学メーカー、下流ユーザーにとっても特に懸念のあるPFASの製造、使用、排出の対応が求められてきた。 PFOS、PFOAについては排出削減や他のPFASへの置き換えなどが進んできている。 最終的に残留性有機汚染物質に関するストックホルム条約により国際的にPFOSは2009年、PFOAは2019年に、ペルフルオロヘキサンスルホン酸(PFHxS)は2022年に新規の製造、輸入が規制された。 しかしながらその他多数のPFASは依然、使用が続いている。 2023年2月に欧州化学品庁(ECHA)はPFAS規制案を公表し、決定後、最長でも13.5年後にはPFASを全廃することを提案している。
PFASによる環境汚染の状況
3M社は外部研究者への委託を通じて、1990年代に極地を含む世界各地の海棲動物の血液や肝臓の試料からPFOSが検出され、既に環境汚染が起きていることを確認した。 日本においては京都大学などの研究グループが2003年には河川水中のPFOSおよびPFOA調査結果を報告し、概ね都市部を通過する大規模な河川で濃度が高く、 PFOSは関東の多摩川水系、PFOAは関西では淀川水系から神崎川水系で濃度が高かった。 排出源は空港や下水処理場からの排水と示唆され、工業用添加剤や空港で使用された消火剤の残留分が排水されているものと考えられた。 飲料水中にもPFOS、PFOAは検出され、浄水過程で完全には除去されず、多摩川の伏流水を水源とする浄水場でも河川水と同程度の濃度で検出されていた。 地下水からPFOS、PFOAが検出され、土壌汚染を通じて汚染が広がっている。 2016年に大阪府の摂津市から近隣の市町にわたって、井戸水から当時の米国環境保護庁の勧告値を大きく超えるPFOAが検出され、 また沖縄県でも2016年に水道事業を運営する沖縄県企業局が、北谷浄水場の取水源でPFOS汚染を確認し、水道水にも残留することを明らかにした。 北谷浄水場は沖縄中部・南部の7市町村の40万人ほどに配水しており、多くの住民にPFOS曝露を引き起こしていた。
日常生活におけるPFAS曝露
上記のように、飲料水源の汚染があればPFAS曝露は増加する。飲料水の汚染が特にみられない地域では食品から摂取が多いと考えられる。 2000年代後半に、1日分の食事を集めて分析する陰膳法による食事調査を行ったところ、一日に約100 ng(ナノグラム=10億分の1グラム)のPFOA、PFOSを摂取していた。 身の回りの生活用品にもPFASを使用されており、2012年までに国内で販売されていた化粧品、日焼け止めを分析したところ、PFAS含有化粧品からは最大で19 μg/gのPFOAなどが検出された。 2020年に流通していた食品容器、衣料品などにもPFOS、PFOA以外のPFASが含まれているものがある。
そのなかで米国の主要ファーストフードチェーンは非PFAS素材への段階的切り替えを表明している。 また米国ニューヨーク州では2020年から食品包装への使用を規制し、2023年末からは衣料品にも規制が導入される。 他のカリフォルニア州などでも種々の製品での規制や表示義務が導入されている。
PFASの血中濃度
PFASは長年の使用から環境に広がっており、血液中には多かれ少なかれPFASが検出される。 PFOS、PFOAが占める割合が多いが、地域によって構成割合は異なり、曝露の状況を反映している。 京都府の住民の血液試料が京都大学では1980年代から保管されており、それを分析したところ、1980年代から2000年にかけて、血中PFOAが4.4倍の増加を示し、その後、3M社の製造廃止などによりPFOS、PFOAは下がってきた。
 点とエラーバーは幾何平均と幾何標準偏差を示す。
点とエラーバーは幾何平均と幾何標準偏差を示す。
排出の削減による、一般的にはPFOS・PFOAの曝露は低下していったと考えられていた。 しかし、上述のように地下水の汚染が続いており、その影響を受ける地域での状況は分かっていなかった。
そのようななか、2019年4月に沖縄県宜野湾市の住民からの調査の要望があり、住民の血液中PFAS濃度を分析する機会を得た。 沖縄県北谷浄水場の配水区域の宜野湾市民の血中PFOS、PFHxS濃度は、配水区域が異なる沖縄本島南部の南城市民より高かった。 また宜野湾市民において、水道水の利用状況で分けると、水道水を利用する市民の血中濃度が利用していない市民よりも有意に高かった。
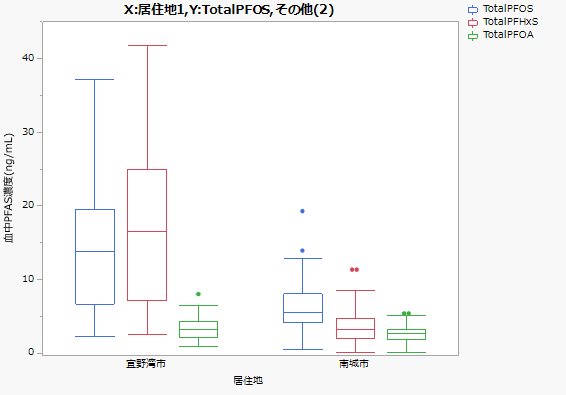
この血中濃度は、環境省により日本のいくつかの地点調査された血中濃度よりも高い。 特にPFHxSは環境省などの調査では平均1 ng/mL以下であるのに対して特異な状況であった。
沖縄では、2022年にも他の市町村での調査も実施され、北谷浄水場の他の配水区域でも同様に高めのPFAS濃度が見られた。 さらに大阪府摂津市、東京都多摩地域でも過去のPFAS使用による影響が続いており、血液中PFAS濃度が高かった。
毒性と健康影響
PFOS、PFOAなどは、代謝性疾患、発達毒性、免疫毒性など多様な毒性を示すことが知られているが、本稿ではがんについてのこれまでの状況を記す。
動物実験では、両物質とも腫瘍を引き起こすことが知られている。 国際がん研究機関(IARC)は2017年にPFOAをGroup 2B(ヒトに対する発がん性が疑われる)とした。 疫学研究がまだ少なかったためである。
動物実験では、PFOSについて甲状腺濾胞腺腫、肝細胞腺腫、乳腺線維腺腫などの有意な増加がみられ、 PFOAについて精巣ライディッヒ細胞腺腫、乳腺線維腺腫、肝細胞がん、膵臓腺房細胞腺腫が見られている。 これらは動物実験ではペルオキシソーム増殖剤活性化受容体を介して起こりやすい腫瘍で、人間では起こりにくいという意見もある。
疫学研究では、3M社などのPFOS、PFOAの製造、使用施設の労働者の調査が行われてきた。 1990年代から2000年代はじめの研究では、PFOA製造業での10年間の従業員経験が前立腺がんの死亡リスクと関連しており、 その標準化死亡比(SMR)は3.3倍(95%信頼区間、1.02から10.6)であること、PFOS製造施設で少なくとも1年間の高曝露または低曝露の経験がある従業員の中で、肝臓がんの死亡が2例観察され、 そのSMRは3.08(95%信頼区間、0.37から11.10)、膀胱がんの死亡リスクは3例が観察され、そのSMRは4.81(95%信頼区間、0.99から14.06)と報告された。
Gilliland FD, Mandel JS. Mortality among employees of a perfluorooctanoic acid production plant. J Occup Med. 1993 Sep;35(9):950-4. doi: 10.1097/00043764-199309000-00020. PMID: 8229349.
https://pubmed.ncbi.nlm.nih.gov/8229349/
Alexander BH, Olsen GW, Burris JM, Mandel JH, Mandel JS. Mortality of employees of a perfluorooctanesulphonyl fluoride manufacturing facility. Occup Environ Med. 2003 Oct;60(10):722-9. doi: 10.1136/oem.60.10.722. PMID: 14504359; PMCID: PMC1740403.
https://oem.bmj.com/content/60/10/722.long
その後の追加調査では膀胱がんとの関連が弱まって、有意でなくなったとも報告された一方で、前立腺がんとの関連が有意なものもあった。
Lundin JI, Alexander BH, Olsen GW, Church TR. Ammonium perfluorooctanoate production and occupational mortality. Epidemiology. 2009 Nov;20(6):921-8. doi: 10.1097/EDE.0b013e3181b5f395. PMID: 19797969.
https://pubmed.ncbi.nlm.nih.gov/19797969/
Alexander BH, Olsen GW. Bladder cancer in perfluorooctanesulfonyl fluoride manufacturing workers. Ann Epidemiol. 2007 Jun;17(6):471-8. doi: 10.1016/j.annepidem.2007.01.036. Epub 2007 Apr 19. PMID: 17448680.
https://pubmed.ncbi.nlm.nih.gov/17448680/
デュポン社(現ケマーズ)のウェストバージニア州ワシントン工場ではPFOAを用いたフッ素樹脂製造を長年行ってきて、その結果、地下水汚染を引き起こした。 ウェストバージニア州とオハイオ州の住民からの集団訴訟(映画「ダーク・ウォーターズ 巨大企業が恐れた男」のもとになった)の和解条件に両州の住民の健康調査を行うことが入った。 独立した科学者3名による調査(C8 Health Project)が行われ、デュポン社の従業員を含む地域住民(およそ69000人)の種々の疾患リスクが調査された。推定累積血清PFOA濃度は、腎臓がんおよび精巣がんと正の関連があった。
Barry V, Winquist A, Steenland K. Perfluorooctanoic acid (PFOA) exposures and incident cancers among adults living near a chemical plant. Environ Health Perspect. 2013 Nov-Dec;121(11-12):1313-8. doi: 10.1289/ehp.1306615. Epub 2013 Sep 5. PMID: 24007715; PMCID: PMC3855514.
https://ehp.niehs.nih.gov/doi/10.1289/ehp.1306615
曝露の低い一般集団での大規模調査では、米国がん研究所のPLCO試験で前立腺がん、腎臓がんとの関連が調査され、前立腺がんとの有意な関連はみられなかったが、腎臓がんとは関連が確認された。
Rhee J, Barry KH, Huang WY, Sampson JN, Hofmann JN, Silverman DT, Calafat AM, Botelho JC, Kato K, Purdue MP, Berndt SI. A prospective nested case-control study of serum concentrations of per- and polyfluoroalkyl substances and aggressive prostate cancer risk. Environ Res. 2023 Jul 1;228:115718. doi: 10.1016/j.envres.2023.115718. Epub 2023 Mar 22. PMID: 36958379; PMCID: PMC10239560.
https://pubmed.ncbi.nlm.nih.gov/36958379/
Shearer JJ, Callahan CL, Calafat AM, Huang WY, Jones RR, Sabbisetti VS, Freedman ND, Sampson JN, Silverman DT, Purdue MP, Hofmann JN. Serum Concentrations of Per- and Polyfluoroalkyl Substances and Risk of Renal Cell Carcinoma. J Natl Cancer Inst. 2021 May 4;113(5):580-587. doi: 10.1093/jnci/djaa143. PMID: 32944748; PMCID: PMC8096365.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8096365/
このほか、甲状腺がん、乳がんなどとの関連が検討されているが、まだ一貫した結果には至っていない。 2023年11月にはIARCモノグラフ会議がPFOA、PFOSについて開催される予定となっている。
日本人の集団ではがん罹患との関連についての研究は限られている。 筆者は、順天堂大学、国立がん研究センターとの共同研究を行っているが、乳がんについて、長野県で行われた病院ベースの症例対照研究では正の相関はみられなかった。
Itoh H, Harada KH, Kasuga Y, Yokoyama S, Onuma H, Nishimura H, Kusama R, Yokoyama K, Zhu J, Harada Sassa M, Tsugane S, Iwasaki M. Serum perfluoroalkyl substances and breast cancer risk in Japanese women: A case-control study. Sci Total Environ. 2021 Dec 15;800:149316. doi: 10.1016/j.scitotenv.2021.149316. Epub 2021 Jul 29. PMID: 34392213.
https://pubmed.ncbi.nlm.nih.gov/34392213/
また前立腺がんのリスクについての研究も開始している。
https://kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-23K09728/
これらで見られた健康影響については、リスクの上昇であり、個人ごとに高い曝露が必ずしもこれらの発がんと関連付けるものではない。 一方で、PFASに曝露する人口は多く、集団としてのリスクを予防、低減する必要がある。
飲料水・血液中PFASに関する勧告値など
米国環境保護庁はじめ、諸機関が飲料水中のPFASについて勧告などを行ってきている。 米国では2016年にPFOAとPFOSの合計値で70 ng/Lとしたが、これは動物実験での発達毒性を指標として定められた。 日本でも、厚生労働省が2020年4月に同じ毒性指標から50 ng/Lの水道水質管理目標値を設定した。
しかし、疫学研究からはより低い濃度でもリスクが懸念されることからより厳しい目標や基準を設定する動きがある。 米国環境保護庁の2022年暫定勧告では、小児の二種混合(DT)ワクチン接種後の抗体価の抑制を指標として、水道水中のPFOS、PFOAの勧告値をそれぞれ0.02 ng/L、0.004 ng/Lを示した。 がんリスクは指標にされなかったのは、リスク評価のための発がんリスク係数が算出されていなかったためである。 いずれにしてもこの濃度は「ほぼゼロ」であり、現在のほとんどの飲料水で達成困難な水準である。 PFAS曝露を可能な限り低減させるべきとの姿勢である。 米国での法的な規制値について、2023年3月に案が公表され、4 ng/Lであった。 これは、検査、処理技術を勘案したものであり、リスクがないことを意味しない。
欧州連合では2023年1月から水道水指令にもとづいて、20種のPFASの合計100 ng/Lを基準とした規制が始まった。 実際に各EU加盟国ではより厳しい基準も取り入れられる予定で、ドイツでは4種のPFASで20 ng/Lを2028年までに導入する。 世界保健機関はPFOS、PFOAについて暫定ガイドライン値案(100 ng/L)を2022年9月に公表したが多くの科学者の反対が寄せられており、正式な公表にはなっていない。
血液中濃度との関連では、健康リスクの予防のための目安として、ドイツ環境庁はHBM-II勧告値を、PFOS血中濃度20 ng/mL、PFOA10 ng/mLと2019年に公表した(妊娠可能年齢の女性はそれぞれ半量)。 この濃度を超える場合には曝露低減が必要とされる。 この健康リスクの対象にはがんリスクは含まれておらず、発達影響、生殖影響、免疫毒性、脂質異常症、糖尿病との関連を対象とした。
米国科学・工学・医学アカデミーは2022年8月に公表した臨床ガイダンスではPFOS, PFHxS, PFOA などの7つのPFASの合計値で20 ng/mLを超える患者へは特別の注意を勧めている。 このガイダンスでは、十分なエビデンスがあるものとして、成人の腎臓がんを挙げ、限定的なエビデンスとして、乳がん、精巣がんのリスクが挙げられた。
これらの勧告値に比べて、汚染が特にない地域において、住民の血中濃度がこれらを上回ることは稀であると考えられる。 しかし、前述の沖縄での血中濃度調査では387人中27人がHBM-IIの値を超えており、水道水中PFAS濃度が高かった地域に分ければ1割近くが超えることになる。 米国アカデミーの臨床ガイダンスとしてはPFHxSも含めて合算値での評価になるので過半数が20 ng/mLを超える。東京多摩地区や、大阪府摂津市でも同様である。
日本では臨床現場で個人の血中PFAS濃度を検査する仕組みが整っていないため、高曝露であることが判明した地域で、このような勧告やガイダンスを参考としてどのように取り組んでいくか、検討が必要である。
今後の課題
PFOSおよびPFOAとも、種々の健康影響が懸念されており、日本人の高曝露集団において、地域での汚染対策を行い、曝露を低減させ、将来の健康リスクを防止する必要がある。また汚染度が低い地域でも、できる限り不必要な曝露を防止することが望まれる。
PFOS、PFOA汚染はいくつかの地域で判明しているが、当然、これまでにPFASが広く使用されてきたことを踏まえれば、全国各地で汚染が生じている可能性を考えなければならない。またPFOS、PFOA以外のPFASのうち、PFHxSについてはストックホルム条約での残留性有機汚染物質として指定されたが、水道水質管理目標値やHBM-IIなどの目安がない。多くの国でPFOS、PFOAと同等の扱いとなっており、PFOS、PFOAだけでなくPFHxSも含めたリスクの評価、管理が必要である。またそれ以外のPFASについては環境中の残留、ヒトへの曝露、健康影響について不明な点が多い。個別の調査は必要であるし、欧州のようにPFAS全体の管理についても範囲を広げていく必要性があるだろう。
なお、環境要因による発がんリスクのレビューが今年に刊行されている。
Iwasaki M, Itoh H, Sawada N, Tsugane S. Exposure to environmental chemicals and cancer risk: epidemiological evidence from Japanese studies. Genes Environ. 2023;45:10. https://genesenvironment.biomedcentral.com/articles/10.1186/s41021-023-00268-3
このレビューの結論として、日本では環境化学物質によるがんリスクの研究が遅れていることを指摘している。PFASのがんリスクの研究についても当てはまることである。研究者はこれまで検討が不十分であった環境化学物質の曝露を新たな領域として認識する必要がある。またその研究を推進するためにはがん疫学と環境科学が領域を超えて協働することが必須であろう。
最後に、PFOS、PFOAの新規製造は廃止されたが、この問題は終わったものではなく、PFAS問題対策の端緒についたばかりである。
2002 京都大学薬学部総合薬学科 卒業
2007 博士(社会健康医学)(京都大学)
2005~2007年日本学術振興会特別研究員
2007~2009年京都大学大学院医学研究科 助教・講師
2009~京都大学大学院医学研究科 准教授、現職
この間2017年02月~2017年08月ソウル国立大学, 公衆衛生大学院, 客員准教授
2018年10月~2021年03月京都大学学際融合教育研究推進センター, 福島復興支援研究連携推進ユニット, 准教授
2022年01月~2022年12月四川大学, 中国政府外国文化教育専門家招聘プロジェクト(ハイエンド外国人専門家紹介計画 ), 国家級外国専門家
所属学会:日本衛生学会、日本環境化学会、日本公衆衛生学会、日本産業衛生学会、日本薬学会、日本疫学会

