『がんの光免疫療法の臨床応用』
小林 久隆
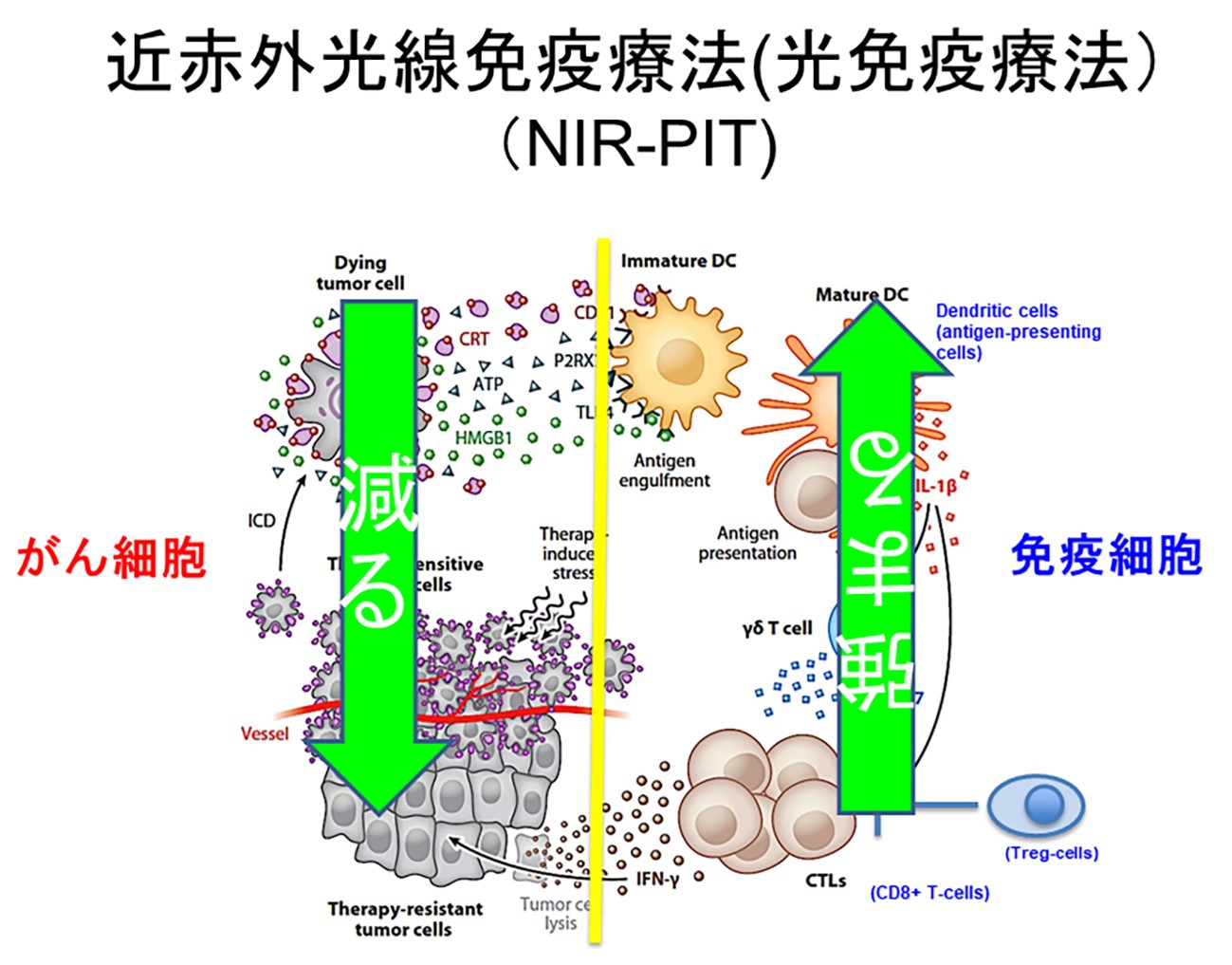
がんの近赤外光線免疫療法(光免疫療法、アルミノックス療法™️) は、 米国国立がん研究所(National Cancer Institute; NCI)・米国国立衛生研究所(National Institutes of Health; NIH)の私の研究室で開発され、 2011年にネイチャー・メデイシン誌に発表された全く新しいタイプのがん治療法である。 日本では、がんの近赤外光線免疫療法(光免疫療法、アルミノックス療法™️) は2020年9月に臨床での再発頭頸部癌患者に対する治療が承認され、2021年当初から治療が保険適応のもと開始された。 この治療の特徴はがん細胞のみを非常に選択的に破壊することができる事にある。 このため、正常の細胞を傷つけることが少なく、副作用を抑えることができるのが1つの大きな特徴である。 また、この治療ではがん細胞を物理的に破壊することによって、がん細胞からその特徴となるタンパク質を放出させることでがんの特徴を患者の体の免疫に認識させることができるためがんに対する免疫を強化できることも、 この治療のもう一つの特徴である。体の中にあるがん細胞を出来る限り減らした上で、体の免疫を強めることができれば、がんを完治させる可能性を高めることが可能になるであろう。(図1) この項では、この私たちの開発した光免疫療法の日本での現状と、これからの将来展望、さらにこの治療の研究開発を進めていくために、関西医科大学に開設した光免疫医学研究所の設立目的にも触れたいと思う。
近赤外光線免疫療法(光免疫療法、アルミノックス療法™️)は、2015年にアメリカで再発頭頸部癌患者に対してEpidermal growth factor receptor(EGFR)標的分子として、 それに対する抗体(セツキシマブ)にIR700という光吸収物質を結合させた薬剤(現在のアキャルクス™️)を用いた第1相試験がアメリカで開始された。 第1相試験は、重大な副作用を見ることなく、十分な効果を確認して終了し、2017年に第2相試験が開始されました。第2相試験でも末期の再発頭頸部癌患者に対して十分な効果を得られたため、2018年から第3相試験がグローバルで開始された。 日本では、日本人に対する第1相試験を海外の第1相試験と同じプロトコールで、2018年に国立がんセンター東病院において3例の患者さんで行われた。 この海外の第2相試験の結果と国内の第1相試験の結果に基づいて、日本では世界に先駆けて、2020年の9月に条件付き早期承認制度に基づいた光免疫療法の治療薬と近赤外光発生装置(レーザーシステム、バイオブレード™️)が薬事承認された。 2021年1月から実際に一般病院における光免疫療法の治療が開始された。 当初は頭頸部がん学会が認める実施可能病院の数が限られていたのだが、2023年現在全国で約100カ所の病院で光免疫療法が行える状況になっている。 ただ今のところ保険が適応となる疾患は再発した頭頸部癌に限られているので、その点は注意が必要である。
また現在、国の承認を受けて保険適用になっている光免疫療法は、この私たちが開発した近赤外光線免疫療法(アルミノックス治療™️)のみであり、 他に光免疫療法を名乗っている治療法は、私たちの治療と同等の効果が得られる事は証明されていません。治療を選択させる際にはこの点にも注意が必要だ。
私たちの光免疫療法の秘密は、使う抗体が狙った細胞にくっついて、そこに光を当てることができれば、どのような細胞であったとしても取り除くために使うことができる技術として開発されている。 従って、いろいろな応用が可能な技術である。このため光免疫療法のこれからの進める方向には大きく分けて2つの方向がある。
一つはこの治療を使って治療することができるがんの種類を増やしていく事である。
もう一つは、この治療技術を使って患者さんの体のがんに対する免疫力を増強することである。
1. 治療できるがんの種類を増やす
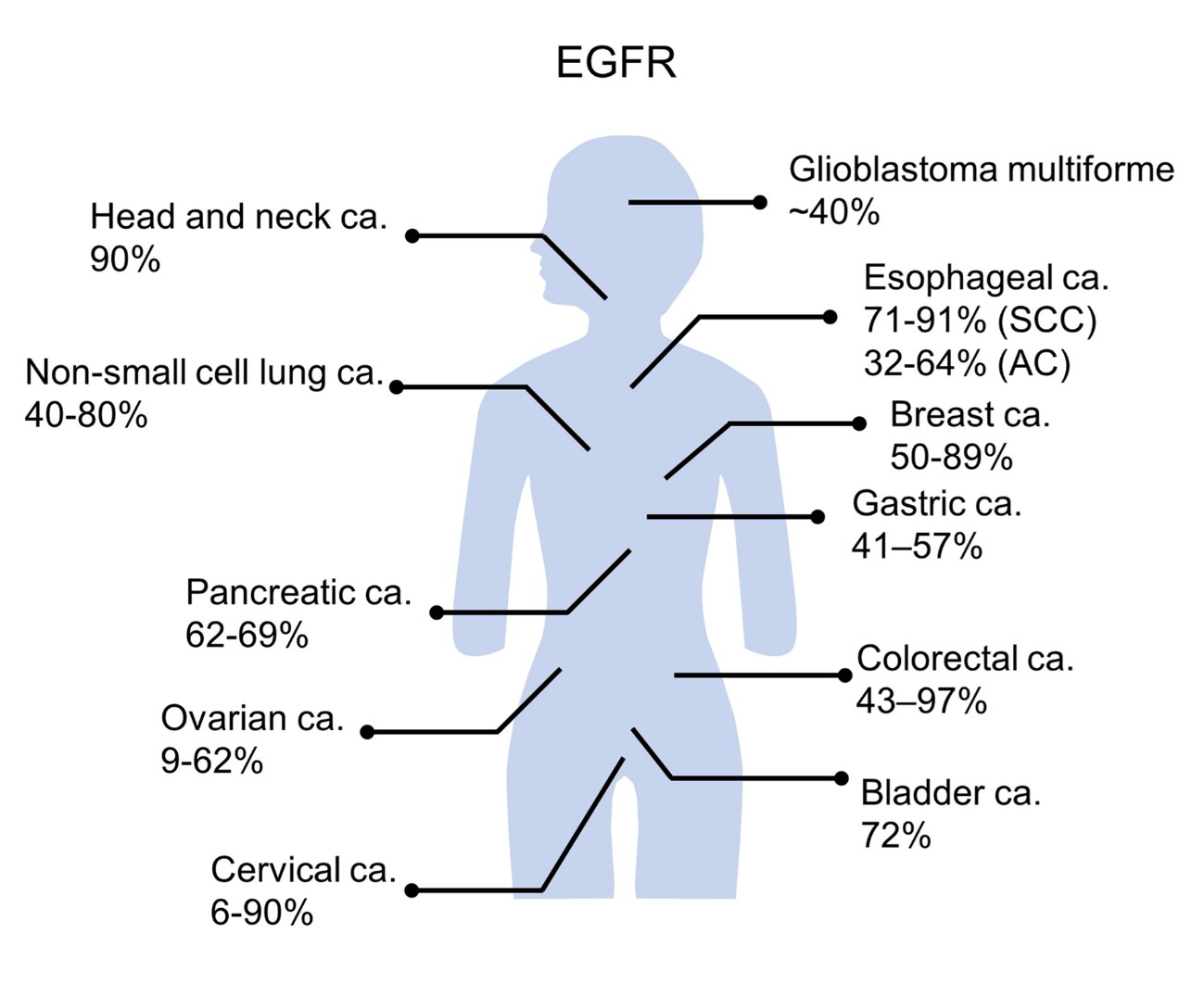
上記に書いた通り、現在日本で治療が認可されている間は、まだ再発の頭頸部がんのみである。 だが、治療に用いられている治療薬は、EGFRと言う分子に結合することによって効果を発揮する治療なので、このEGFRが発現しているがん細胞であれば理論的にも実験においても同様の効果を得ることができている。 実際、EGFRを標的分子として選んだ理由は、この分子が最も高い確率で、固形癌に発現していることにある。 EGFRは、頭頸部顔以外にも、食道がん、子宮頸がん、乳がん、大腸がん、肺がんなど多くの癌に比較的高率に発現している。(図2) またもちろん頭頸部癌においても再発したがんのみではなく、初発のがんにもEGFRは高率に発現している。 したがって現在認可されたこの薬剤セツキシマブIR 700 (アキャルックス™️)は、このようながんにも効果がある可能性が理論的には高いわけである。 従って1つの方向性として、これらがんにこの薬の適用を拡大していくことが、より多くのがん患者さんの治療を可能にする近道であると考えている。
もう一つの方向は、新たな標的分子に対する抗体を使った薬剤を作成して、さらに治療できるがんの種類を増やしていく方法である。 これまでの既存の抗体医薬でも、様々な標的分子に結合する抗体が使われてきている。 例えば、乳がんにおけるHER2、前立腺がんにおけるPSMA、大腸がんや胆管癌におけるCEAなどが既に抗体医薬で使用されている標的分子になる。 これらの抗体にIR700を結合させたものを用いることによって、現在使われているこのEGFR抗体を用いる薬剤と同等の効果がある事は、動物実験で十分に示されてきている。(4) このような次の抗体薬剤を作成して適用できるがん種を増やしていくこともこの治療法をより広いがんの患者さんに使っていく方向性になるであろう。 新規抗体の作成は基本的には楽天メデイカル社の方針によっている。 楽天メデイカル社からはすでに、PDL1抗体を用いた新薬の作成が発表されている。 新たな活動として、光免疫療法の広報活動・研究支援を目的にした特定非営利活動(NPO)法人光免疫療法研究支援会(https://photoimmunotherapy.or.jp/)が有志により設立された。 同法人では光免疫療法の研究支援のためのファンドレイジングを行っている。 同法人への寄付金の一部は、本研究の創薬に対する支援金として提供される予定で、すべてを楽天メデイカル社の資金に委ねるのではなく、 確実に役に立つと患者、医師の両者が確信できる薬剤を、一般の資金で創薬し、賛同してもらえるNIHの前立腺がんチームでフェーズ1の治験を行う計画である。 この枠組みでは、アメリカ政府の機関を使って最も信頼性の高いデータを非常に安価に取ることができるので、人に使えるところまでの創薬を企業が行う場合の半分以下の10億円程度で行うことができるので、 臨床適応までの道をかなり縮めることができる。 賛同できる方は、是非ご協力いただければ幸いである。
2. 体のがんに対する免疫力を増強する
光免疫療法には、がんを直接壊す光治療の部分だけでなく、体の免疫力を安全に増強する免疫療法の能力も持っている。
がんが体内で育っていく上で、重要な要素に体の中にある免疫抑制細胞の存在がある。 これらの細胞は、がんを体の免疫から守ってがんが育ちやすい環境を作ってしまっている細胞である。 もともとは人の体の免疫が強くなりすぎて、自分の細胞を攻撃しないように働いている細胞なのであるが、これらの細胞ががんを攻撃しないように働いてしまうと、その場所にがんが育ちやすい環境になってしまうわけである。 がんを壊すと同時に、このような免疫抑制細胞癌の周辺で壊してやると免疫が正常に働くようになって、がんを消し去ってしまうと同時に再発も抑えることができるようになる。(5) この治療を実現するために、私たちはまず制御性T細胞と言うリンパ球系の免疫抑制細胞をCD25と言う分子を標的にして除去する方法の臨床治験が国立がんセンター中央病院で始まっている。 さらに、改良されたCD25抗体の臨床への投入も視野に入れた開発を私のチームでも行っている。
この方法が使用可能になった暁には、がんを直接攻撃する抗体とこの免疫抑制細胞を攻撃する抗体薬剤を同時に投与して、がん細胞と同時に、免疫抑制細胞も除去することで、 これまでとは次元の異なるがん治療を実現するという最終目標を持って、現在研究及び臨床試験を進めている。
光免疫療法は、日本で最初に実臨床への使用が認可されたので、治験を行っている海外とは異なり、多くの症例とその治療情報が得られるようになっている。 このような治療法の開発は、どれだけ動物実験を行っても、実臨床の現場で起こることを全て予測して解決する事は不可能である。 したがって臨床現場からの情報で、この治療はよりブラッシュアップされて、患者さんにとってより良い治療となっていくことができるはずである。
この臨床からの情報をより効率よく受け取って、この治療の研究を進めていくために、日本に研究拠点を持ちたいと考えていたところ、 2019年に関西医科大学からこの治療に特化した研究者の設立をオファーしていただく機会を得た。 2020年からのコロナ禍のために日米間を自由に往来することができず、この計画の遂行は困難を極めたが、幸い2022年4月に研究所を開所することができた。 この研究所は、基盤開発部門、免疫部門、腫瘍病理学部門の3教室を有する上に、所長直属の化学薬品開発チームを備えている。 2023年2月現在、研究所の主要メンバーは既に揃ったが、半導体不足などで機器は調達が遅れてフル稼働できるまでにはもう少しかかりそうである。 これらが全て整えば十分な能力を有する光免疫療法の研究を中心にした研究所となるであろう。 関西医科大学の臨床側には、光免疫療法センターを設立していただき、臨床と研究所の連携を密に取れるように整備しているので、臨床との距離も大変近い研究所になることとであろう。
私のNCI/NIHの研究室で、この治療を共に開発し、共に学んできた若い研究者たちも、すでに二十数名日本に戻って研究を続けているので、 彼らの研究ネットワークのコアとしても機能して、この研究所は日本での光免疫療法研究開発の中心となることができると考えている。
この項では、近赤外光線免疫療法(光免疫療法、アルミノックス治療™️)の日本での現状、これからの展望及び、この治療に特化した日本での新研究所、関西医科大学・光免疫医学研究所の設立経緯に関して述べた。 専門家にも読んでいただけるように科学的に正確を期して書いたこともあり、やや難しい内容になっているかもしれない。 少し難しすぎると感じられる方は、一般向けにこの治療に関して書いて頂いた新潮社新書の芹澤健介さんの著書「がんの消滅:天才医師が挑む光免疫療法」か、 光文社新書の自著「がんを瞬時に破壊する光免疫療法 身体にやさしい新治療が医療を変える」などを参考にしていただければ幸いである。
定価:本体760円+税

◆がんの消滅 天才医師が挑む光免疫療法
定価:本体840円+税

1961年、兵庫県西宮市生まれ。 現在、NIH/NCI(アメリカ国立衛生研究所・国立がん研究所)分子イメージングブランチ主任研究員として勤務。 87年、京都大学医学部を卒業し、95年に京都大学大学院内科系核医学を専攻し修了、医学博士号取得。 同年に渡米、NIH臨床研究センターフェローに。98年に帰国し、京都大学医学部助手を経て、2001年に再渡米、NIHのNCIにシニアフェローとして勤務、05年から現職に。 11年、光免疫療法の論文が米医学誌『Nature Medicine』に掲載される。 光免疫療法の研究・開発により14年にNIH長官賞、17年にNCI長官個人表彰を受賞。他に7回のNIH Tech Transfer Award等を受賞。 22年4月より関西医科大学光免疫医学研究所所長(無給)を兼任。

