�O��W���Ö@�ɍs���l�܂������҂̍�
�w�V���ȕی��O���p�̎d�g�݂̑n�݁x
���t�{�������v���i��
�Q�����@��F �T��
�Q�����@��F �T��
�u���������v�A�u�����Ă��������v�Ɗ肢�V���V�������Ë@��̎g�p�����]���銳�҂�Ƒ��̊肢�̑O�ɗ����͂�����A
�u�����F��v�A�u�����F�@��v�Ƃ����傫�ȕǁB
���̕ǂɔ����Ȍ��Ԃ������J���悤�Ƃ��Ă���̂��u���Ґ\�o�×{�i���́j�v���x���B
������Ő����̌����݂ƌ����Ă��邪�A��N�U���S���u�����F�̈��i���̐v���Ȏg�p�����߂�
�w�ی��O���p�×{��x�ɂ�����V���Ȏd�g�݂Ɋւ���ӌ��x�v
http://www.com-info.org/ima/ima_20140604.html
�Ɉ��������A����ɂ��ē��t�{�������v���i���̑�F �T��Q�����ɂ����������B �ȉ��͋K�����v�S����b�ƌ����J����b�̍��ӕ����ł���B
���Ґ\�o�×{���x�̑n�݂ɂ�����A�K�����v�S����b�ƌ����J����b�̊Ԃʼn��L�̍��ӂ��Ȃ���A���݂���ɉ����Ė@�ē�����������Ă��܂��B�{�s�͕����Q�W�N�S���̗\��ɂȂ�܂��B
http://www.com-info.org/ima/ima_20140604.html
�Ɉ��������A����ɂ��ē��t�{�������v���i���̑�F �T��Q�����ɂ����������B �ȉ��͋K�����v�S����b�ƌ����J����b�̍��ӕ����ł���B
�i��c�@����Y�j
���Ґ\�o�×{���x�̑n�݂ɂ�����A�K�����v�S����b�ƌ����J����b�̊Ԃʼn��L�̍��ӂ��Ȃ���A���݂���ɉ����Ė@�ē�����������Ă��܂��B�{�s�͕����Q�W�N�S���̗\��ɂȂ�܂��B
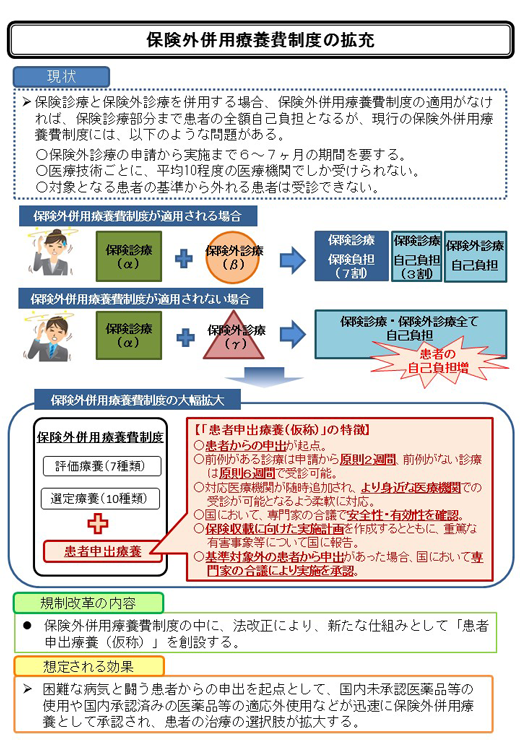
�P�D��|
����ȕa�C�Ɠ������҂���̐\�o���N�_�Ƃ��āA���������F���i���̎g�p�⍑�����F�ς݂̈��i���̓K���O�g�p�Ȃǂ� �v���ɕی��O���p�×{�Ƃ��Ďg�p�ł���悤�A�ی��O���p�×{��x�̒��ɁA�@�����ɂ��A �V���Ȏd�g�݂Ƃ��āu���Ґ\�o�×{�i���́j�v��n�݂��A���҂̎��Â̑I�������g�傷��B
�Q�D�Ή����j
�u���Ґ\�o�×{�i���́j�v�́A��t�����Â̓��e����S���E�L�����Ȃǂ����҂ɑ��ď\���������A ���҂������A�[�����������Ő\�o���邱�Ƃ�O��Ƃ���B �Ή���Ë@�ւ̈��S�E�K�Ȑf�Ñ̐��������Ă��邱�Ƃ��m�F���A�f�Ó��e�ɉ����āA �ł��邾�����҂ɐg�߂Ȉ�Ë@�ւŁA�v���Ɏ�f�ł���悤�ɂ���B
�i�P�j�Ή���Ë@��
�����F�̐f�ÂɊւ���L�x�Ȓm����L����Տ��������j�a�@�Ɗ��҂ɐg�߂Ȓn��̈�Ë@�ւ��A �f�Ó��e�ɉ����ĘA�g���͂�}��Ȃ���A���҂���̐\�o�ɌW��f�Â��ł���̐����\�z����B
���Ⴆ�A���X�N�̍������̂͑�w�a�@��n��̊�a�@�A ���X�N�̒Ⴂ���̂͑Ή��\�Ȓn��̕a�@�Ŏ���悤�ɂ���B
�����҂���̐\�o�ɑΉ��ł��Ȃ��ꍇ�́A���{�\�Ȉ�Ë@�ւɏЉ��B
�i�Q�j���F�܂ł̊���
�@�u���Ґ\�o�×{�i���́j�v�Ƃ��Ă̑O�Ⴊ����f��
�Տ��������j�a�@�̑��A���҂ɐg�߂Ȉ�Ë@�ցi�\�苦�͈�Ë@�֓��j���A���҂���\�o���A �O�����舵�����Տ��������j�a�@�ɑ��Đ\���i���������̐\���j����B �i�]���͗Տ��������j�a�@�������������̐\���j
�\�����猴���Q�T�ԂŗՏ��������j�a�@�����f���A��f�ł���悤�ɂ���B
�A�u���Ґ\�o�×{�i���́j�v�Ƃ��Ă̑O�Ⴊ�Ȃ��f�×Տ��������j�a�@���A���҂���\�o���A���ɑ��Đ\������B
�\�����猴���U�T�Ԃō������f���A��f�ł���悤�ɂ���B
���҂ɐg�߂Ȉ�Ë@�ւ��ŏ�����Ή���Ë@�ցi���͈�Ë@�ցj�Ƃ��Đ\���i���������̐\���j����ꍇ�́A ���̈�Ë@�ւŎ�f�ł���悤�ɂ���B
�����O���k�������p����B
�����̊��Ԃ��ĐR���Ɏ��Ԃ�v����ꍇ�i�_���̕��ʂ������A��w�I���f��������铙�j�A ���͗��R��t���ėՏ��������j�a�@�ɒʒm����B
�i�R�j�Ή���Ë@�ւ̏[��
�@ �Տ��������j�a�@�́A�P�T�����Ɍ��肷�邱�ƂȂ��A�v�������Βlj����Ă����B
�����݁A���̗v���������a�@��Տ��������j�a�@�Ƃ��ď��F����@���x�荞��Ö@�����Ă��o���B
�A �Տ��������j�a�@���\�����ɑΉ���Ë@�ցi���������̗\�苦�͈�Ë@�ցj�̃��X�g��Y�t���A ���҂��g�߂Ɏ�f�ł����Ë@�ւ����m����B
�B �Տ��������j�a�@�̏��F�ɂ��A�Ή���Ë@�ցi���͈�Ë@�ցj�𐏎��lj�����B���̎|�A���J�Ȃ�����v������B
�R�D���S���E�L�������̊m�F
�i�P�j���ɂ����āA���Ƃ̍��c�ň��S���E�L�������m�F����B
�G�r�f���X�̂���f�Â͂ł��邾���ΏۂƂ�����j�ʼn^�p����B
�����ł̋c�_��葱����v���������I�ɐi�߂邽�߁A�^�c�̂�����ɂ��āA�V�����d�g�݂̎{�s�܂łɌ�������B
�i�Q�j�ی����ڂɌ����A�������ɐi�ނ��߂̔��f���ł���悤�A���{�v����쐬���A���ɂ����Ċm�F����ƂƂ��ɁA ���{�ɔ����d�ĂȗL�Q���ۂ���{�A���ʓ��ɂ��ĕ����߂�B
�ی����ڂ̂��߂̒����I�ȕ]�����K�v�Ȃ��̂��ΏۂƂ���B
�i�R�j���{�v��̑ΏۊO�̊��҂���\�o���������ꍇ�́A�Տ�����
���j�a�@�ɂ����Ĉ��S���A�ϗ������ɂ��Č������s������ŁA���ɂ����Đ��Ƃ̍��c�ɂ����{�����F����B